Forschende der ETH Zürich vermelden einen technologischen Durchbruch: Sie haben eine Methode entwickelt, mit der sich Mitochondrien – die winzigen Kraftwerke innerhalb einer Zelle – mit einer unübertroffenen Effizienz von einer lebenden Zelle in eine andere übertragen lassen.
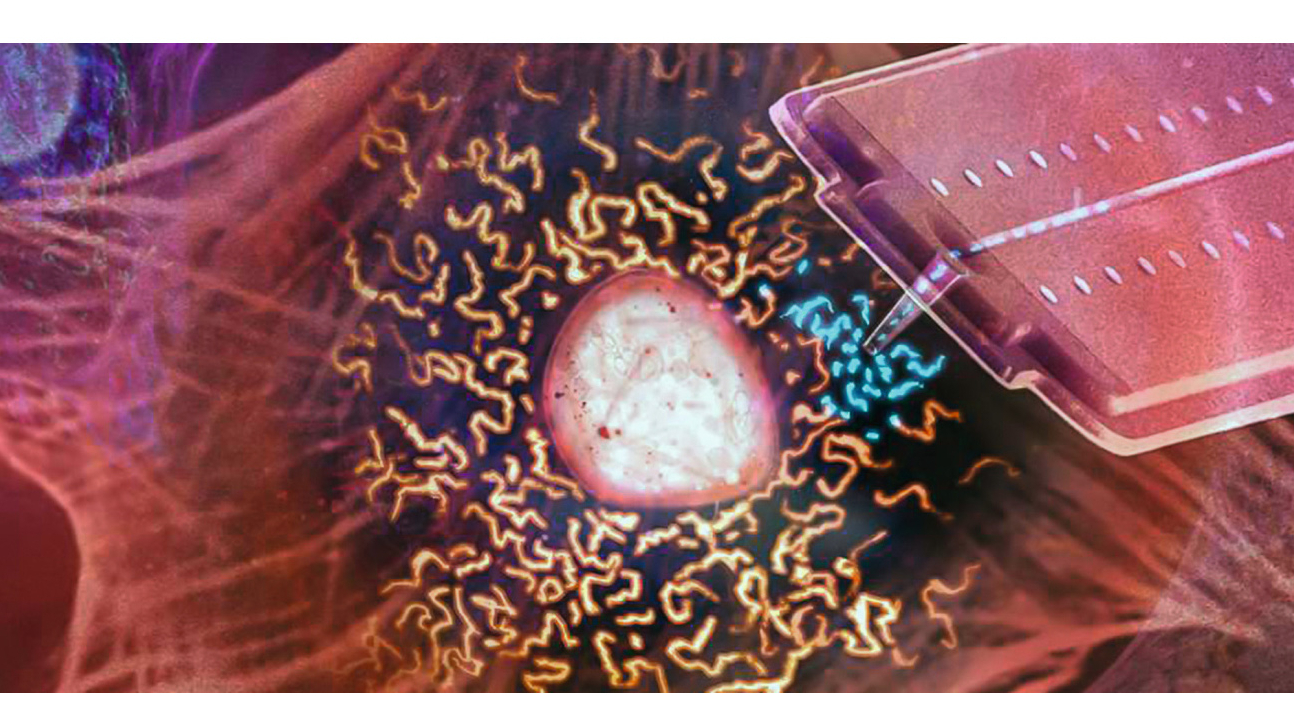
Organtransplantion Zellebene: Mit einer Nanospritze saugen Forschende Mitochondrien (blau) aus einer lebenden Zelle auf, um die Organellen in eine andere zu übertragen
So wie sich der menschliche Körper in verschiedene Organe – etwa Herz, Lungen, Nieren, Darm oder Leber – unterteilen lässt, bestehen auch unsere Zellen aus mehreren, sich ergänzenden und voneinander abhängigen Systemen, die in der Fachsprache als Organellen (also kleinen Organen) bezeichnet werden. Und so wie das Leben eines nierenkranken Menschen mit der Transplantation einer gesunden Niere mitunter um mehrere Jahrzehnte verlängert werden kann, könnten dereinst vielleicht einzelne Zellen mit der Transplantation von Zellbestandteilen aufgefrischt werden.
Dass dieses Gedankenexperiment kein Hirngespinst ist, sondern in den Bereich des technisch Machbaren gerückt ist, zeigen die neuen Befunde der Forschungsgruppe um Julia Vorholt vom Institut für Mikrobiologie an der ETH Zürich. Wie die Wissenschaftlerinnen und Wissenschaftler soeben in der Fachzeitschrift PLos Biology berichten, haben sie mithilfe einer Nanospritze, die sie zuvor entwickelt haben, Mitochondrien von einer lebenden Zelle in eine andere verpflanzt.
In diesen winzigen Kraftwerken der Zellen finden die biochemischen Prozesse der Zellatmung statt, die sich schon vor mehr als zwei Milliarden Jahren in Bakterien herausgebildet hatten. Später bildeten einige Bakterien mit anderen Zellen eine enge Gemeinschaft, eine so genannte Endosymbiose. Sie spielt in der Stammesgeschichte des Lebens auf der Erde eine zentrale Rolle: Erst sie ermöglichte die Entwicklung von Pilzen, Pflanzen oder Tieren (einschließlich uns Menschen), die alle aus komplexen Zellen aufgebaut sind.
![Mitochondrien-Transplantation (A) Schema der Mitochondrientransplantation unter Verwendung des Zell-zu-Zell-Transferansatzes: Mitochondrien werden durch FluidFM- Absaugung extrahiert. Anschließend wird der Cantilever, der den Extrakt enthält, zu einer Empfängerzelle bewegt und der Extrakt wird injiziert. (B) Bild eines mit Perfluoroktan vorgefüllten FluidFM- Cantilevers nach der Mitochondrienextraktion, Mitochondrien sind mit su9-mCherry markiert. Das extrahierte Volumen beträgt etwa 0,8 pL. Maßstabsbalken: 10 μm. (C) Schema der Mitochondrientransplantation unter Verwendung von Mitochondrien, die nach einem Standardprotokoll für die Mitochondrienreinigung aufgereinigt wurden. Die gereinigten Mitochondrien werden in HEPES-2-Puffer resuspendiert und direkt in die Fluidiksonde gefüllt. Die Zellen werden nacheinander injiziert. (D) Bild eines FluidFM-Cantilevers, der mit aus der Masse isolierten, mit su9-mCherry markierten Mitochondrien gefüllt ist. Skalenbalken: 10 μm. (E) Bilder einer Empfängerzelle nach der Transplantation von Mitochondrien über den Zell-zu-Zell-Ansatz. Das mitochondriale Netzwerk der Wirtszellen ist mit su9-BFP markiert, das Transplantat mit su9-mCherry. Skalenbalken: 10 μm. (F) Bilder einer Empfängerzelle nach der mitochondrialen Transplantation durch Injektion isolierter Mitochondrien, Markierungen wie bei c. Maßstab: 10 μm. (G) Bewertung der Mitochondrientransplantation über den Zell-zu-Zell-Ansatz nach optischer Inspektion und dem Ansatz der Injektion isolierter Mitochondrien. Es wurden insgesamt 40 Zellen pro Ansatz ausgewertet. (H) Absolute Anzahl der transplantierten Mitochondrien von 22 einzelnen Zellen, die für den Zell-zu-Zell-Ansatz und die Injektion von isolierten Mitochondrien ausgewertet wurden. (I) Fusionszustände der transplantierten Mitochondrien 30 Jahre nach der Transplantation von Zelle zu Zelle. Die Mitochondrien werden mit verschiedenen Fluoreszenzmarkierungen für das Transplantat (su9-mCherry) und für das Wirtsmitochondriennetzwerk (su9-BFP) sichtbar gemacht. Skalenbalken: 5 μm. (J) Fusionszustände der transplantierten Mitochondrien 30 nach der Injektion von gereinigten Mitochondrien, ähnliche Markierung wie in g. Maßstab: 5 μm. (K) Abbau der transplantierten Mitochondrien, das Transplantat ist in mehrere kleinere fluoreszierende Vesikel (su9-mCherry) aufgeteilt, die keine Überlappung der Fluoreszenz mit dem markierten Mitochondriennetzwerk der Wirtszelle (su9-BFP) aufweisen. Skalenbalken: 5 μm. (L) Zeitraffer-Bildserie eines einzelnen transplantierten Mitochondriums (su9-mCherry). Die Organellen- spenderin war eine HeLa-Zelle, die Empfängerzelle ist eine U2OS-Zelle mit einem fluoreszenzmarkierten mitochondrialen Netzwerk (su9-BFP). Skalenbalken: 10 μm (Quelle: [2]) Mitochondrien-Transplantation (A) Schema der Mitochondrientransplantation unter Verwendung des Zell-zu-Zell-Transferansatzes: Mitochondrien werden durch FluidFM- Absaugung extrahiert. Anschließend wird der Cantilever, der den Extrakt enthält, zu einer Empfängerzelle bewegt und der Extrakt wird injiziert. (B) Bild eines mit Perfluoroktan vorgefüllten FluidFM- Cantilevers nach der Mitochondrienextraktion, Mitochondrien sind mit su9-mCherry markiert. Das extrahierte Volumen beträgt etwa 0,8 pL. Maßstabsbalken: 10 μm. (C) Schema der Mitochondrientransplantation unter Verwendung von Mitochondrien, die nach einem Standardprotokoll für die Mitochondrienreinigung aufgereinigt wurden. Die gereinigten Mitochondrien werden in HEPES-2-Puffer resuspendiert und direkt in die Fluidiksonde gefüllt. Die Zellen werden nacheinander injiziert. (D) Bild eines FluidFM-Cantilevers, der mit aus der Masse isolierten, mit su9-mCherry markierten Mitochondrien gefüllt ist. Skalenbalken: 10 μm. (E) Bilder einer Empfängerzelle nach der Transplantation von Mitochondrien über den Zell-zu-Zell-Ansatz. Das mitochondriale Netzwerk der Wirtszellen ist mit su9-BFP markiert, das Transplantat mit su9-mCherry. Skalenbalken: 10 μm. (F) Bilder einer Empfängerzelle nach der mitochondrialen Transplantation durch Injektion isolierter Mitochondrien, Markierungen wie bei c. Maßstab: 10 μm. (G) Bewertung der Mitochondrientransplantation über den Zell-zu-Zell-Ansatz nach optischer Inspektion und dem Ansatz der Injektion isolierter Mitochondrien. Es wurden insgesamt 40 Zellen pro Ansatz ausgewertet. (H) Absolute Anzahl der transplantierten Mitochondrien von 22 einzelnen Zellen, die für den Zell-zu-Zell-Ansatz und die Injektion von isolierten Mitochondrien ausgewertet wurden. (I) Fusionszustände der transplantierten Mitochondrien 30 Jahre nach der Transplantation von Zelle zu Zelle. Die Mitochondrien werden mit verschiedenen Fluoreszenzmarkierungen für das Transplantat (su9-mCherry) und für das Wirtsmitochondriennetzwerk (su9-BFP) sichtbar gemacht. Skalenbalken: 5 μm. (J) Fusionszustände der transplantierten Mitochondrien 30 nach der Injektion von gereinigten Mitochondrien, ähnliche Markierung wie in g. Maßstab: 5 μm. (K) Abbau der transplantierten Mitochondrien, das Transplantat ist in mehrere kleinere fluoreszierende Vesikel (su9-mCherry) aufgeteilt, die keine Überlappung der Fluoreszenz mit dem markierten Mitochondriennetzwerk der Wirtszelle (su9-BFP) aufweisen. Skalenbalken: 5 μm. (L) Zeitraffer-Bildserie eines einzelnen transplantierten Mitochondriums (su9-mCherry). Die Organellen- spenderin war eine HeLa-Zelle, die Empfängerzelle ist eine U2OS-Zelle mit einem fluoreszenzmarkierten mitochondrialen Netzwerk (su9-BFP). Skalenbalken: 10 μm (Quelle: [2])](/images/stories/Abo-2022-05/thumbnails/thumb_gt-2022-05-0024.jpg) Mitochondrien-Transplantation (A) Schema der Mitochondrientransplantation unter Verwendung des Zell-zu-Zell-Transferansatzes: Mitochondrien werden durch FluidFM- Absaugung extrahiert. Anschließend wird der Cantilever, der den Extrakt enthält, zu einer Empfängerzelle bewegt und der Extrakt wird injiziert. (B) Bild eines mit Perfluoroktan vorgefüllten FluidFM- Cantilevers nach der Mitochondrienextraktion, Mitochondrien sind mit su9-mCherry markiert. Das extrahierte Volumen beträgt etwa 0,8 pL. Maßstabsbalken: 10 μm. (C) Schema der Mitochondrientransplantation unter Verwendung von Mitochondrien, die nach einem Standardprotokoll für die Mitochondrienreinigung aufgereinigt wurden. Die gereinigten Mitochondrien werden in HEPES-2-Puffer resuspendiert und direkt in die Fluidiksonde gefüllt. Die Zellen werden nacheinander injiziert. (D) Bild eines FluidFM-Cantilevers, der mit aus der Masse isolierten, mit su9-mCherry markierten Mitochondrien gefüllt ist. Skalenbalken: 10 μm. (E) Bilder einer Empfängerzelle nach der Transplantation von Mitochondrien über den Zell-zu-Zell-Ansatz. Das mitochondriale Netzwerk der Wirtszellen ist mit su9-BFP markiert, das Transplantat mit su9-mCherry. Skalenbalken: 10 μm. (F) Bilder einer Empfängerzelle nach der mitochondrialen Transplantation durch Injektion isolierter Mitochondrien, Markierungen wie bei c. Maßstab: 10 μm. (G) Bewertung der Mitochondrientransplantation über den Zell-zu-Zell-Ansatz nach optischer Inspektion und dem Ansatz der Injektion isolierter Mitochondrien. Es wurden insgesamt 40 Zellen pro Ansatz ausgewertet. (H) Absolute Anzahl der transplantierten Mitochondrien von 22 einzelnen Zellen, die für den Zell-zu-Zell-Ansatz und die Injektion von isolierten Mitochondrien ausgewertet wurden. (I) Fusionszustände der transplantierten Mitochondrien 30 Jahre nach der Transplantation von Zelle zu Zelle. Die Mitochondrien werden mit verschiedenen Fluoreszenzmarkierungen für das Transplantat (su9-mCherry) und für das Wirtsmitochondriennetzwerk (su9-BFP) sichtbar gemacht. Skalenbalken: 5 μm. (J) Fusionszustände der transplantierten Mitochondrien 30 nach der Injektion von gereinigten Mitochondrien, ähnliche Markierung wie in g. Maßstab: 5 μm. (K) Abbau der transplantierten Mitochondrien, das Transplantat ist in mehrere kleinere fluoreszierende Vesikel (su9-mCherry) aufgeteilt, die keine Überlappung der Fluoreszenz mit dem markierten Mitochondriennetzwerk der Wirtszelle (su9-BFP) aufweisen. Skalenbalken: 5 μm. (L) Zeitraffer-Bildserie eines einzelnen transplantierten Mitochondriums (su9-mCherry). Die Organellen- spenderin war eine HeLa-Zelle, die Empfängerzelle ist eine U2OS-Zelle mit einem fluoreszenzmarkierten mitochondrialen Netzwerk (su9-BFP). Skalenbalken: 10 μm (Quelle: [2])
Mitochondrien-Transplantation (A) Schema der Mitochondrientransplantation unter Verwendung des Zell-zu-Zell-Transferansatzes: Mitochondrien werden durch FluidFM- Absaugung extrahiert. Anschließend wird der Cantilever, der den Extrakt enthält, zu einer Empfängerzelle bewegt und der Extrakt wird injiziert. (B) Bild eines mit Perfluoroktan vorgefüllten FluidFM- Cantilevers nach der Mitochondrienextraktion, Mitochondrien sind mit su9-mCherry markiert. Das extrahierte Volumen beträgt etwa 0,8 pL. Maßstabsbalken: 10 μm. (C) Schema der Mitochondrientransplantation unter Verwendung von Mitochondrien, die nach einem Standardprotokoll für die Mitochondrienreinigung aufgereinigt wurden. Die gereinigten Mitochondrien werden in HEPES-2-Puffer resuspendiert und direkt in die Fluidiksonde gefüllt. Die Zellen werden nacheinander injiziert. (D) Bild eines FluidFM-Cantilevers, der mit aus der Masse isolierten, mit su9-mCherry markierten Mitochondrien gefüllt ist. Skalenbalken: 10 μm. (E) Bilder einer Empfängerzelle nach der Transplantation von Mitochondrien über den Zell-zu-Zell-Ansatz. Das mitochondriale Netzwerk der Wirtszellen ist mit su9-BFP markiert, das Transplantat mit su9-mCherry. Skalenbalken: 10 μm. (F) Bilder einer Empfängerzelle nach der mitochondrialen Transplantation durch Injektion isolierter Mitochondrien, Markierungen wie bei c. Maßstab: 10 μm. (G) Bewertung der Mitochondrientransplantation über den Zell-zu-Zell-Ansatz nach optischer Inspektion und dem Ansatz der Injektion isolierter Mitochondrien. Es wurden insgesamt 40 Zellen pro Ansatz ausgewertet. (H) Absolute Anzahl der transplantierten Mitochondrien von 22 einzelnen Zellen, die für den Zell-zu-Zell-Ansatz und die Injektion von isolierten Mitochondrien ausgewertet wurden. (I) Fusionszustände der transplantierten Mitochondrien 30 Jahre nach der Transplantation von Zelle zu Zelle. Die Mitochondrien werden mit verschiedenen Fluoreszenzmarkierungen für das Transplantat (su9-mCherry) und für das Wirtsmitochondriennetzwerk (su9-BFP) sichtbar gemacht. Skalenbalken: 5 μm. (J) Fusionszustände der transplantierten Mitochondrien 30 nach der Injektion von gereinigten Mitochondrien, ähnliche Markierung wie in g. Maßstab: 5 μm. (K) Abbau der transplantierten Mitochondrien, das Transplantat ist in mehrere kleinere fluoreszierende Vesikel (su9-mCherry) aufgeteilt, die keine Überlappung der Fluoreszenz mit dem markierten Mitochondriennetzwerk der Wirtszelle (su9-BFP) aufweisen. Skalenbalken: 5 μm. (L) Zeitraffer-Bildserie eines einzelnen transplantierten Mitochondriums (su9-mCherry). Die Organellen- spenderin war eine HeLa-Zelle, die Empfängerzelle ist eine U2OS-Zelle mit einem fluoreszenzmarkierten mitochondrialen Netzwerk (su9-BFP). Skalenbalken: 10 μm (Quelle: [2])
So haben sich aus den uralten Bakterien im Lauf der Zeit Mitochondrien gebildet: Organellen, die in den heutigen komplexen Zellen für die Energiegewinnung zuständig sind. In menschlichen Zellen bilden Mitochondrien ein fadenartiges dynamisches Netzwerk. «Die Fäden reagieren auf Unterdruck – und verwandeln sich in eine Art Perlenkette, von der sich einzelne Mitochondrien abspalten», sagt Christoph Gäbelein, der Erstautor des Fachbeitrags.
![Schematische Darstellung der Organellextraktion und -injektion mit FluidFM. (A) Das Extraktionsvolumen wird durch Anlegen eines Unterdrucks (-Δp) eingestellt. Die Vorfüllung der Sonde mit Octadecafluoroctan ermöglicht die optische und physikalische Trennung des Extrakts innerhalb des Cantilevers. (B) Selektive Extraktion von Organellenkomponenten durch Abstimmung der Öffnungsgröße und damit des Bereichs der anwendbaren Strömungskräfte. Obere Reihe: Schematische Darstellung der extrahierten Zellkomponenten innerhalb des Cantilevers. Mittlere Reihe: Rasterelektronenmikroskopische Aufnahmen von Cantilever-Spitzen mit unterschiedlichen Öffnungen. Untere Reihe: Bereich der anwendbaren Fluidikkräfte mit angepassten FluidFM-Cantilevern. Maßstabsleiste: 2 μm. (C) Schematische Darstellung der Injektion von Mitochondrien in einzelne Zellen durch Anlegen von Überdruck (+Δp), sobald der Cantilever in die Empfängerzelle eingeführt wurde. ER, Endoplasmatisches Retikulum (Quelle: [2]) Schematische Darstellung der Organellextraktion und -injektion mit FluidFM. (A) Das Extraktionsvolumen wird durch Anlegen eines Unterdrucks (-Δp) eingestellt. Die Vorfüllung der Sonde mit Octadecafluoroctan ermöglicht die optische und physikalische Trennung des Extrakts innerhalb des Cantilevers. (B) Selektive Extraktion von Organellenkomponenten durch Abstimmung der Öffnungsgröße und damit des Bereichs der anwendbaren Strömungskräfte. Obere Reihe: Schematische Darstellung der extrahierten Zellkomponenten innerhalb des Cantilevers. Mittlere Reihe: Rasterelektronenmikroskopische Aufnahmen von Cantilever-Spitzen mit unterschiedlichen Öffnungen. Untere Reihe: Bereich der anwendbaren Fluidikkräfte mit angepassten FluidFM-Cantilevern. Maßstabsleiste: 2 μm. (C) Schematische Darstellung der Injektion von Mitochondrien in einzelne Zellen durch Anlegen von Überdruck (+Δp), sobald der Cantilever in die Empfängerzelle eingeführt wurde. ER, Endoplasmatisches Retikulum (Quelle: [2])](/images/stories/Abo-2022-05/thumbnails/thumb_gt-2022-05-0023.jpg) Schematische Darstellung der Organellextraktion und -injektion mit FluidFM.
Schematische Darstellung der Organellextraktion und -injektion mit FluidFM.
(A) Das Extraktionsvolumen wird durch Anlegen eines Unterdrucks (-Δp) eingestellt. Die Vorfüllung der Sonde mit Octadecafluoroctan ermöglicht die optische und physikalische Trennung des Extrakts innerhalb des Cantilevers. (B) Selektive Extraktion von Organellenkomponenten durch Abstimmung der Öffnungsgröße und damit des Bereichs der anwendbaren Strömungskräfte. Obere Reihe: Schematische Darstellung der extrahierten Zellkomponenten innerhalb des Cantilevers. Mittlere Reihe: Rasterelektronenmikroskopische Aufnahmen von Cantilever-Spitzen mit unterschiedlichen Öffnungen. Untere Reihe: Bereich der anwendbaren Fluidikkräfte mit angepassten FluidFM-Cantilevern. Maßstabsleiste: 2 μm. (C) Schematische Darstellung der Injektion von Mitochondrien in einzelne Zellen durch Anlegen von Überdruck (+Δp), sobald der Cantilever in die Empfängerzelle eingeführt wurde. ER, Endoplasmatisches Retikulum (Quelle: [2])
Mit eigens für diese Studie entwickelten, schräg endenden und zylinderförmigen Nanopipetten stachen die Forschenden durch die Zellmembran – und saugten die kugelförmigen Mitochondrien ein. Dann stachen sie durch die Membran einer anderen Zelle und pumpten die Mitochondrien wieder aus der Nanopipette heraus in die Empfängerzelle. (siehe Abbildung)
Die Position der Nanopipette wird vom Laserlicht eines umfunktionierten Rasterkraftmikroskops kontrolliert. Ein Druckregler passt den Flüssigkeitsstrom an. Dadurch lassen sich während einer Organellentransplantation unvorstellbar kleine Volumen im Femtoliterbereich bewegen. Sowohl die Donor- wie auch die Akzeptorzellen überleben diese minimalinvasive Prozedur (siehe Abbildung).
Auch über 80 % der transplantierten Mitochondrien überstehen die Operation. In den meisten Zellen beginnen die injizierten Mitochondrien nach zwanzig Minuten mit dem fadenartigen Netzwerk der neuen Zelle zu fusionieren. „Sie werden von der Wirtszelle akzeptiert“, sagt Julia Vorholt. Nur in wenigen Zellen fallen sie der Qualitätskontrolle der neuen Wirtszellen zum Opfer – und werden abgebaut.
„In Zukunft wird die hier vorgestellte Technik Anwendungen in verschiedenen Forschungsbereichen ermöglichen“, schreiben die Forschenden. Vorstellbar sei, dass sich damit etwa Stammzellen verjüngen lassen, deren Stoffwechselaktivität mit zunehmendem Alter nachlässt. Doch das Team um Vorholt verfolgt andere Pläne. „Wir wollen die Prozesse verstehen, die die Zusammenarbeit der verschiedenen Zellkompartimente steuern – und nachvollziehen, wie sich Endosymbiosen im Laufe der Zeit evolvieren“, sagt Vorholt.
Literatur
[1] Quelle: ETH Zürich
[2] Gäbelein CG, Feng Q, Sarajlic E, Zambelli T, Guillaume-Gentil O, Kornmann B, Vorholt JA. Mitochondria transplantation between living cells. PLoS Biol. 20: Published: March 23, 2022, doi: 10.1371/journal.pbio.3001576call_made